
Les enzymes sont impliquées dans des processus biologiques essentiels mais leur fragilité est un obstacle à l’obtention de leurs structures intactes par des méthodes conventionnelles de biologie structurale.
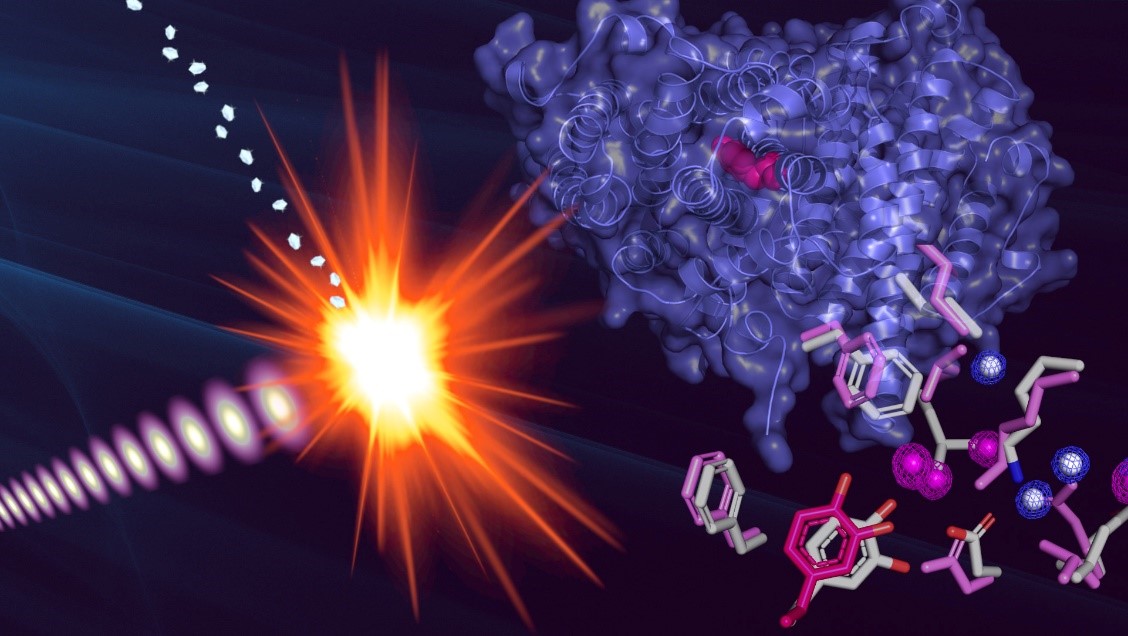
Hugo Lebrette (LMGM-CBI) et ses collaborateurs ont pu observer pour la première fois la structure atomique de l’état radicalaire, un état extrêmement réactif, d’une enzyme, la ribonucléotide réductase de mycoplasme, grâce à la cristallographie en série couplée à un laser ultra rapide.
Hugo Lebrette et ses collaborateurs ont relevé ce défi grâce au concept de « diffraction avant destruction », en illuminant un flot de cristaux de protéine avec un laser ultra rapide où chaque impulsion dure quelques femtosecondes.
Ce résultat, qui permet une compréhension inédite de la structure d'une enzyme, ouvre la voie à de potentielles innovations thérapeutiques.
© Martin Högbom et Hugo Lebrette
Figure : Structure de la sous-unité R2 de la ribonucléotide réductase de mycoplasme obtenue par cristallographie femtoseconde en série par laser à rayons X à électrons libres. La superposition des acides aminés entre les deux états, radicalaire (rose) et non-radicalaire (gris), montre les changements conformationnels induits par l’acquisition du radical.
 Pour en savoir plus :
Pour en savoir plus :
 Contact : Hugo Lebrette
Contact : Hugo Lebrette








 Pour en savoir plus :
Pour en savoir plus :  Contact :
Contact : 



